W. D. Hutchison1, Suzanne Wold-Burkness1, y Angie Ambourn2
1Departamento de Entomología, Universidad de Minnesota
2Departamento de Agricultura de Minnesota
Introducción
El cecidómido de la coliflor o mosquito de la col, Contarinia nasturtii, (Díptera: Cecidomyiidae) es una plaga que ataca casi todos los cultivos vegetales de la familia de la mostaza (del género Brassica: brócoli, coles de Bruselas, repollo, coliflor, hojas de mostaza, col rizada, así como también la canola (colza), cultivo oleaginoso de alto valor agronómico. Además, existen más de 20 especies de malezas que sirven como huéspedes, incluyendo el rábano silvestre, bolsa de pastor, carraspique del campo y cohete amarillo. El mosquito de la col es nativo de Europa y fue detectado por primera vez en Norteamérica en Toronto, Canadá, en 2000. De allí se diseminó a New York en 2004 y recientemente, en 2016 se encontró en Minnesota.
 |
 |
Biología
Los mosquitos adultos de la col son de un color café claro, de aproximadamente 2 mm de largo y casi no se distinguen de otros mosquitos a menos que se use magnificación. En Michigan y New York los adultos emergen de principios a mediados de la primavera. Los huevos son extremadamente pequeños (de menos de 0.5mm), de color crema y son depositados en racimos en el tejido joven que está creciendo activamente en las plantas huéspedes. Las larvas son cilíndricas y transparentes al principio y se oscurecen tomando un color amarillo cremoso cuando alcanzan su instar final y llegan a medir 3-4mm de largo. Las larvas se alimentan en racimos hasta alcanzar su instar final, cuando caen de la planta huésped al suelo donde se transforman en pupas. En Michigan se producen de tres-cinco generaciones de mayo a octubre.
Daños
El mosquito de la col pertenece a la familia Cecidomyiidae, cuyos miembros producen agallas, es decir, sus picaduras provocan la distorsión del tejido de la planta. Los daños producidos por las picaduras del mosquito de la col varían desde la apariencia fruncida y cicatrices del tejido de las hojas, hasta plantas con “cabezas ciegas” (coles sin cabeza). Síntomas similares se pueden atribuir a otras causas, como deficiencias nutricionales y daño causado por herbicidas; por consiguiente, para hacer una identificación precisa se necesita observar la presencia de la larva.
 |
 (Julie Kikkert,Bugwood.org). |
 No se formará la cabeza de coliflor (MN Dept. of Ag.). |
Manejo
La prevención de una infestación antes de que suceda quizás sea la medida más importante que se puede tomar. Debe haber comunicación con el proveedor de trasplantes para asegurarse que se están adquiriendo trasplantes libres de plagas, para no introducir inadvertidamente el mosquito de la col a las granjas. Si los trasplantes están infestados, se debe empapar el suelo o los trasplantes con un insecticida aprobado antes de la siembra.
Preferencia varietal del mosquito de la col
Investigadores de la Universidad de Guelph (Ontario, Canadá), condujeron pruebas en 2001-2003 para determinar la susceptibilidad de cultivares de brócoli, repollo, coliflor y coles de Bruselas al mosquito de la col. Descubrieron que el brócoli es el más susceptible. De las clases de brócoli que evaluaron, ‘Paragon’, ‘Eureka’ y ‘Packman’ tuvieron el más alto nivel de daños en los tres años que duró el estudio, mientras que ‘Triathlon’, ‘Regal’ y ‘Everest’ demostraron baja susceptibilidad y más bajo desarrollo de síntomas en al menos uno de los tres años. En los tres años del estudio, no hubo diferencia en susceptibilidad entre repollo verde y rojo, o entre cultivares de coliflor blanca, roja o vino tinto; las coles de Bruselas ‘Jade Cross’ demostraron baja susceptibilidad al mosquito de la col.
Monitoreo

Además de monitorear a los adultos, los campos se deben explorar para detectar daños causados por la larva. La exploración se debe concentrar en los bordes del campo, buscando hojas fruncidas y cicatrices o cabezas ciegas (Figuras 3-5). Aunque hay trampas disponibles para el monitoreo de los mosquitos adultos de la col (machos), esta es una especie extremadamente críptica, los mosquitos adultos pueden ya estar poniendo huevos, con larvas causando daños, antes de que se detecte el adulto en las trampas. Los investigadores de Cornell recomiendan el uso de una trampa blanca Jackson (Scentry Biological Inc., Billings, MT), la cual es una trampa blanca pegajosa que contiene un señuelo de feromona. Las trampas se deben colocar cerca del suelo y se deben chequear semanalmente. Investigaciones previas en New York y Canadá descubrieron que la presencia de 5 mosquitos/trampa puede indicar que ya hay depósito de huevos y daño debido a la picadura de larvas. Si se detectan mosquitos en las trampas es mejor tomar pasos proactivos para minimizar el riesgo de infestaciones.
Control de cultivos
Rotación de los cultivos: Se ha observado que la producción de poblaciones de mosquitos de la col se acumula en el suelo, por lo cual la rotación de los cultivos es extremadamente importante. Los investigadores de Cornell recomiendan la rotación de los cultivos de Brassica por un mínimo de tres años. Además, se deben controlar las malezas en áreas cercanas a los campos de cultivo. Cualquier maleza que sea un huésped idóneo para el mosquito de la col deberá ser destruida.
Saneamiento y destrucción de cultivos: A pesar de que no tenemos datos específicos del mosquito de la col, estudios llevados a cabo recientemente con otras plagas similares (ej. mosca de la fruta, drosófila de alas manchadas), demuestran que el empaque de plantas infestadas en bolsas plásticas transparentes y su exposición a la luz del sol por 4-5 días, debe generar suficiente calor (ej. más de 120-140F) dentro de las bolsas para matar los mosquitos de la col. Este puede ser un método práctico para cultivos pequeños o comunitarios, especialmente si se han detectado mosquitos de la col recientemente. Después de 5-7 días, el contenido de las bolsas se puede enterrar o destruir.
Opciones de compostaje: Nuevamente, sin tener investigaciones específicas del mosquito de la col, aun podemos considerar los beneficios del compostaje para su control. Aunque este método puede que sea menos efectivo que el embolsamiento del material vegetal posiblemente es más factible para productores mayores. Idealmente, el material vegetal infestado con mosquitos de la col debe colocarse en una pila de compostaje (sistema) que provea aireación/ luz solar suficiente para alcanzar temperaturas de 120-140F. En Minnesota, si un condado (ej. el condado de Ramsey) mantiene un sitio municipal de compostaje, y la granja que es la fuente del material vegetal está localizada en el mismo condado, el material vegetal se puede acarrear hacia el sitio municipal de compostaje. Sin embargo, en el caso del condado de Hennepin, donde el material vegetal se transporta con frecuencia a otro condado que no se sabe si está infestado, el sitio municipal no se puede utilizar. Quizás la mejor opción, particularmente para una plaga invasiva, es el compostaje del material en el mismo lugar, para minimizar el movimiento de la plaga.
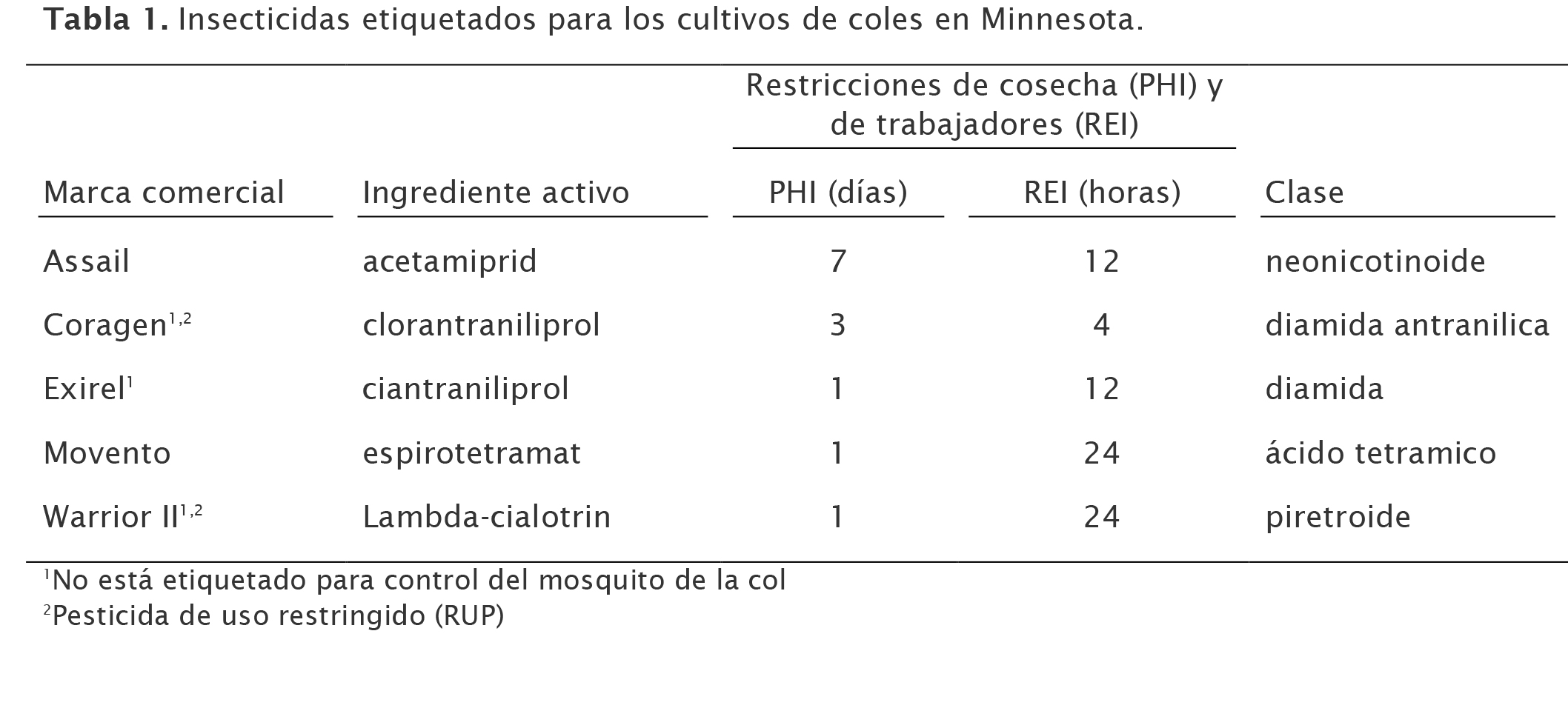
Control químico
El mosquito de la col se puede controlar con fumigación preventiva con insecticidas. La captura por medio de trampas es una herramienta efectiva para determinar cuando la población está emergiendo del suelo. Cuando los cultivos de coles están bajo mucha presión, la fumigación con rotaciones de siete a nueve días ha comprobado ser efectiva en otros estados.
Información proveniente de Michigan State University, indica que neonicotinoides sistémicos son una herramienta útil para controlar esta plaga. En un estudio conducido en invernaderos de New York, aplicaciones al follaje con Assail 30SG (acetamiprid) fueron capaces de controlar larvas en trasplantes de coliflor, fumigando a intervalos de nueve días. Los campos de cultivo presentan un mayor reto debido a que el mosquito tiene la tendencia a esconderse del insecticida de contacto en la parte inferior de las hojas cerca del ápice creciente. En estudios efectuados en New York, el tratamiento de semillas con clotianidina y tiametoxam produjeron un control de larvas de 100 por ciento durante 3-5 semanas, y el empapamiento del suelo con acetamiprid, imidacloprid y tiametoxam comprobaron ser 100 por ciento efectivos para controlar las larvas por un período de hasta 7 semanas.
Cuando se aplican estos tratamientos al principio de la estación se puede lograr la reducción del número recomendado de aplicaciones foliares, pero un estudio realizado por las Universidades de Guelph y Cornell indicaron que tratamientos suplementarios con insecticidas foliares en los campos de cultivo a mediados y a finales de la estación son especialmente importantes para el control del mosquito de la col. La mayoría de los insecticidas de piretroides, carbamatos y organofosfatos son letales para el mosquito de la col. Estos insecticidas incluyen lambda-cialotrin, permetrina, acetamiprid, clorpirifos y dimetoato. El Bacillus thuringiensis subsp. israeliensis causó la mortalidad del 50 por ciento de larvas en el ámbito del laboratorio, pero no se ha encontrado ningún material orgánico certificado (OMRI-aprobado) que sea efectivo en los campos de cultivo. Estos insecticidas no fueron efectivos en reducir las poblaciones de mosquitos por sí mismos. Para manejar efectivamente esta plaga, la aplicación de insecticidas en un horario apropiado con rotación de las distintas clases de químicos, así como el control de las malezas huéspedes es esencial para reducir las poblaciones.
Referencias relacionadas
Kikkert, J., C. Hoepting, A. Shelton, M. Chen, P. Wang, Q. Wu, J.-Z. Zhao. 2017. Swede midge information center for the United States. Cornell University. Retrieved from http://web.entomology.cornell.edu/shelton/swede-midge/index.html
Minnesota Department of Agriculture. 2017. Swede Midge. Retrieved from http://www.mda.state.mn.us/plants/insects/swedemidge.aspx
Phillips, B. 2015. Swede midge, an invasive pest of cole crops, has been discovered in Michigan, presenting a new management challenge where present. Michigan State University Extension. Retrieved from http://msue.anr.msu.edu/news/swede_midge_biology_and_management
Philips, C., A. Ambourn, and L. Christianson. 2017. First detections of Swede midge (Diptera: Cecidomyiidae) in Minnesota. J. Entomol. Sci. 52(3): 297-300. Retrieved from http://www.bioone.org/doi/abs/10.18474/JES17-32.1
Stokes, B. 1953. The host plant range of the Swede midge (Contarinia nasturtii kieffer) with special reference to types of plant damage. Tidsskr. Planteavl. 59: 82-90. https://doi.org/10.1007/BF02106324
Updated April, 2021